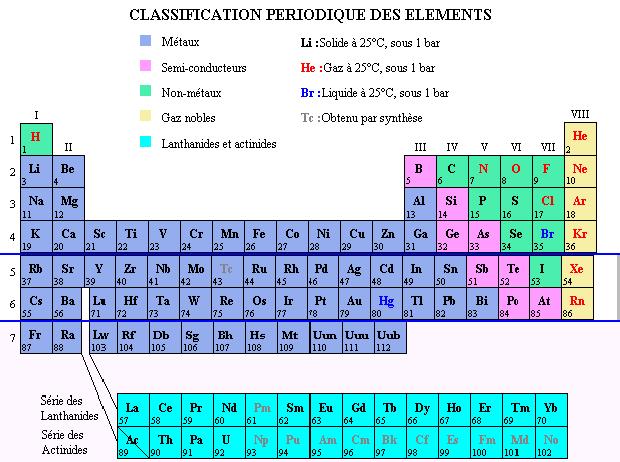
La classification périodique
Ouvrir une classification périodique très complète au format .swf (flash)
|
|||||||||||||||
Tableau périodique réalisé par le lycée Galilée de Rouen
|
|||||||||||||||
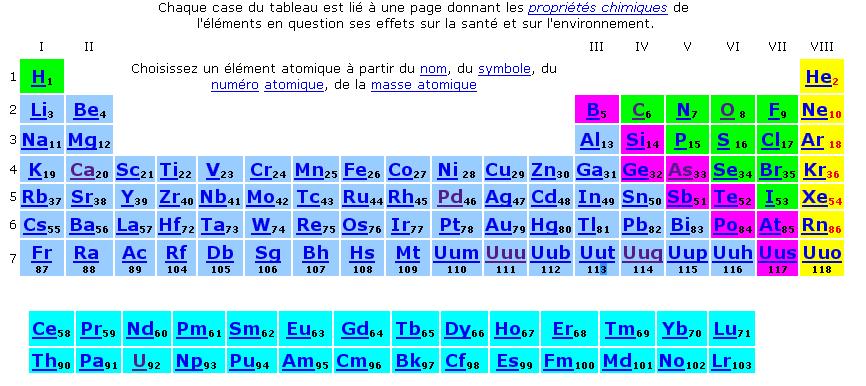
Une autre classification périodique En cliquant sur l'image ci dessous
vous arrivez sur un tableau périodique qui vous permettra
d'accéder facilement à des pages qui décrivent
( en cinq langues) les effets sur la santé et sur l'environnement
des différents éléments chimiques.
|
|||||||||||||||
|
|||||||||||||||
Dans une colonne
du tableau , les atomes ont le même nombre d'électron sur leur
dernière coucheélectronique. Ceci leur donne des
propriétés chimiques très similaires car
les propriétés chimiques d'unélément
sont essentiellement déterminées par les électrons
de la couche électronique la plus externe. |
|||||||||||||||
|
|||||||||||||||