| Il existe
une centaine d'atomes différents, environ trois fois
plus si on tient compte de leurs différents isotopes.
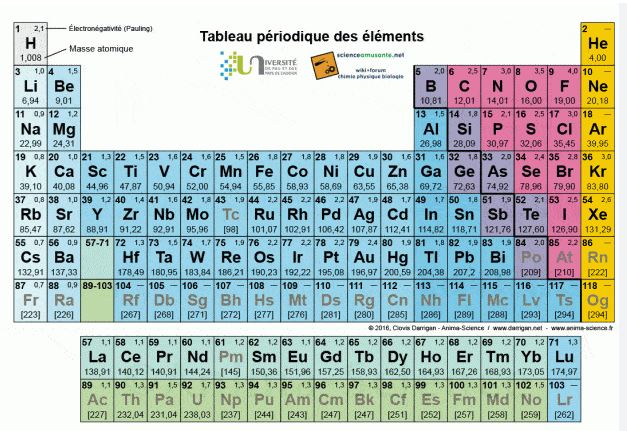
Les atomes ont été classés en fonction
de leur structure et de leurs propriétés chimiques
dans la classification
périodique des éléments.
Leurs propriétés chimiques sont déterminées
par le nombre d'électrons
qui se trouvent sur leur couche électronique la plus
externe.
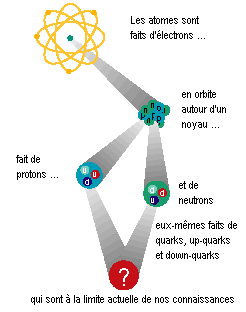
Structure des atomes
Pour chaque atome :
- le noyau est constitué de nucléons ( protons
et neutrons ) chacun étant environ 2000 fois plus lourd
que l'électron
- le nombre de proton d'un atome est égal à son
nombre d'électron , il est noté Z (nombre de charge
) ou numéro atomique
- le nombre de nucléons (protons + neutrons ) est noté
A nombre de masse
Des atomes qui ont le même nombre de
proton, mais un nombre de neutron différent sont des
isotopes.
Certain sont stables et leur durée de vie se mesure en
milliards d'années, d' autres sont instables ou radioactifs.
Les différents isotopes d'un atomes ont les mêmes
propriétés chimiques
Les protons portent une charge électrique
positive = + 1,602×10-19 C (Coulomb)
Ils ont une masse de 1,6726×10-27 kg
Les électrons une charge électrique
négative de même valeur = + 1,602 ×1 0-19
C
Leur masse est de 9,1094 ×10-31 kg
La position des électrons autour du
noyau n' est pas définie par une trajectoire, mais par
une probabilité de les trouver dans un espace autour
de celui ci appelé nuage électronique.
La théorie qui permet d'interpréter (ou de prévoir
) les résultats expérimentaux en physique atomique
est la mécanique
quantique.
Plus précisemment, les interactions entre la lumière et la matière (ou entre les
photons et les électrons ) constituent le domaine
de l'électrodynamique quantique
De nombreuses informations sur les atomes proviennent de leur
spectre d'émission et d'absorption
des ondes electromagnetiques.
L 'atome le plus léger est celui d'
hydrogène. Il est formé
uniquement d'un proton et d'un électron.
Origine des atomes
Les noyaux des atomes les plus simples comme ceux des atomes
d' hydrogène ( H ), de deutérium, de tritium
et d' hélium ( He, A= 4, Z=2 ) se sont formés
dans les stades
les plus précoces de la formation de l'univers. (environ
3 mn après le Big - Bang , stade de la
nucléosynthèse primordiale d' après
le
modèle standart de la cosmologie).
Les autres ont été formés au sein
des étoiles lors de nucléosynthèses
stellaires contituées de réactions de fusion
nucléaire se produisant au sein d 'étoiles.
Les noyaux des atomes les plus lourds ont été
formés lors de l'explosion de Supernovae.
Les noyaux et les électrons n 'ont pu stabiliser sous
forme d'atomes que lorque la température de l'univers
a suffisamment refroidie, c'est à dire au moment de l'
émission du fond diffus cosmologique dont l'age est estimé
a 380 000 années après le big bang.
Atomes et molécules => voir
chimie
Atome et particules élémentaires
Alors que l'electron est considéré
comme une particule élémentaire, protons et neutrons
sont eux même chacun constitués de 3 particules
élémentaires nommées Quarks Up et Down
, en interaction avec des gluons.
La masse du proton (environ 2000 fois celle de l' électron
) peut aussi être exprimée en unité
d'énergie d'après la célèbre
relation d' Einstein ( E = MC 2 ), elle vaut environ un
Gev ( giga électron volt) .
Lorqu'il qu'il sagit d'étudier les constituants élémentaires
des noyaux atomiques (quarks, gluons ), il faut alors utiliser
la Théorie
Quantique des Champs (Relativistes ) et des accellérateurs/collisionneurs
de particules comme celui du C.E.R.N..
En biologie : les atomes les plus fréquents sont :
C , H ,O , N, P, S, ( ils constituent
environ 99 % de la masse des êtres vivants )
|